1. Observaciones preliminares
El acetileno
tiene propiedades particulares que hacen de este gas prácticamente
insustituible para soldadura con gas oxicorte y corte. Estas propiedades son
también significativas en términos de seguridad, y debe tenerse en cuenta
cuando se trabaja con el acetileno con el fin de prevenir accidentes.
.jpg) En éste consejo
de seguridad se describen las propiedades de acetileno que son relevantes para
la seguridad, y proporcionar consejos prácticos para trabajar con seguridad con
este gas.
En éste consejo
de seguridad se describen las propiedades de acetileno que son relevantes para
la seguridad, y proporcionar consejos prácticos para trabajar con seguridad con
este gas.
Estas
instrucciones se complementan, pero no reemplazan, las estipulaciones
obligatorias, como el código de acetileno y las reglas técnicas para los
equipos de acetileno.
2. Propiedades químicas
Peligro de explosión:
No permita una
mezcla incontrolada de acetileno y aire u oxígeno
El acetileno se
combina con el aire o el oxígeno para formar una mezcla explosiva que puede ser
encendida por una chispa o similar, y puede causar una grave explosión.
Para eliminar
este peligro, tome las siguientes precauciones:
• Para evitar que
grandes cantidades de acetileno se filtre en el aire ambiente, los sistemas de
acetileno deben ser a prueba de fugas en la conexión del cilindro a la
antorcha. Las fugas que se producen deben ser reparadas inmediatamente. Las
mangueras de acetileno deben cumplir los requisitos de la norma DIN EN 559. Las
conexiones según DIN EN 560 debe ser utilizadas para conectar las mangueras
entre sí y al equipo. Proteja las mangueras de los daños, y reemplazarlas a
intervalos apropiados. Cerrar las válvulas del cilindro de acetileno durante
las pausas de trabajo.
Aviso de sustancia inflamable:
• Antes de
encender una antorcha, cualquier presencia de aire en la manguera de acetileno
debe ser purgada con acetileno para evitar la formación y el encendido de una
mezcla de acetileno / aire en la manguera.
• Con pocas
excepciones, los sistemas de un solo cilindro de acetileno deben estar
equipados con una válvula de control instalado en la manguera de la antorcha,
que bloquea el flujo de oxígeno en el tubo de acetileno y por lo tanto previene
la formación de una mezcla de acetileno / oxígeno en la manguera. También un
supresor de retroceso de llama se debe instalar directamente en el regulador
del cilindro de acetileno, para prevenir la propagación de las llamas a los
cilindros de acetileno.
• En la manguera
de oxigeno se debe instalar un dispositivo justo antes de la antorcha para
evitar la entrada de acetileno en la manguera cuando la presión del oxígeno sea
baja.
No transfiera el acetileno
.jpg) Cada molécula de
acetileno se mantiene unida por un „triple enlace“ que se puede romper bajo la
acción del calor o la presión extrema. Esto hace que las moléculas de acetileno
se descompongan en sus componentes: carbono (hollín) y el agua. Esta reacción
de descomposición puede ocurrir de forma explosiva y puede tener un
considerable efecto destructivo.
Cada molécula de
acetileno se mantiene unida por un „triple enlace“ que se puede romper bajo la
acción del calor o la presión extrema. Esto hace que las moléculas de acetileno
se descompongan en sus componentes: carbono (hollín) y el agua. Esta reacción
de descomposición puede ocurrir de forma explosiva y puede tener un
considerable efecto destructivo.
Molécula de C2H2
Cuanto mayor sea
la presión y la temperatura del gas, el acetileno se descompone más fácilmente.
La descomposición del acetileno es poco probable que ocurra dentro de un
cilindro de acetileno, ya que su volumen está completamente lleno de un sólido
poroso, masa cuyos poros contienen el acetileno disuelto en acetona. Este
sistema de seguridad sólo es eficaz si la relación cuantitativa entre el
acetileno disuelto y el disolvente acetona no exceda de ciertos límites. Los
cilindros de acetileno por lo tanto, deben llenarse de gas sólo después de que
el contenido de acetona ha sido comprobado y se reponga si es necesario. La
transferencia de acetileno de un cilindro a otro está por lo tanto prohibido.
A pesar de la presencia de este sistema de seguridad, en
condiciones desfavorables, una reacción de descomposición puede ocurrir dentro
del cilindro. Para eliminar este peligro, los cilindros de acetileno deben
estar protegidos del calor excesivo. A pesar de los cilindros de acetileno
puede soportar largos períodos de exposición a la luz del sol, el contacto
directo con una llama puede ser peligroso. Por lo tanto, la soldadura, y el uso
de cualquier otro tipo de llama está prohibido a menos de 1 metro de un
cilindro de acetileno. Para las baterías de cilindros de acetileno que contiene
hasta seis cilindros de acetileno (considerados „sistemas pequeños“) éste radio
es de 3 metros, para las baterías con más de seis cilindros de acetileno es de
5 metros. Las antorchas de soldadura y las mangueras no deben estar colgando en
los cilindros de acetileno. Sistemas fijos de la batería con más de seis
cilindros de acetileno, los cilindros no deben ser instalados en la sala en la
que la soldadura se lleva a cabo. Si se produce un incendio en las
inmediaciones de los cilindros de acetileno, si es posible, sacarlos de la zona
amenazada o enfriarlos con agua intensamente.
Los
dispositivos de acetileno utilizados no están protegidos frente a la
descomposición de acetileno en la misma forma que el cilindro. Acetileno por lo
tanto, debe ser retirado del cilindro sólo a través de un regulador del
cilindro de acetileno, lo que limita la presión en la manguera de un máximo de
1,5 bar por encima de la presión atmosférica. Los Reguladores de los cilindros
de acetileno debe ser aprobados por el modelo, y deben llevan la etiqueta de
aprobación (por ejemplo, 01D - D 52.172).
Estado físico
Uso
los cilindros de acetileno en posición vertical
.jpg) Como
ya se mencionó, el acetileno está disuelto en acetona en el interior del
cilindro. Cuando la válvula del cilindro se abre, el acetileno en forma gaseosa
fluye, al igual que el dióxido de carbono cuando una botella de agua con gas se
abre. Para evitar que la inflamable acetona salga de la botella, los cilindros
de acetileno deben estar en posición vertical, mientras que el gas está
fluyendo, o se debe colocar la válvula del cilindro por lo menos 40 cm más alto
que la base del cilindro. Esta precaución puede ser ignorada para cilindros que
tienen una „alta porosidad“, indicado por un anillo rojo alrededor del cuello
del cilindro.
Como
ya se mencionó, el acetileno está disuelto en acetona en el interior del
cilindro. Cuando la válvula del cilindro se abre, el acetileno en forma gaseosa
fluye, al igual que el dióxido de carbono cuando una botella de agua con gas se
abre. Para evitar que la inflamable acetona salga de la botella, los cilindros
de acetileno deben estar en posición vertical, mientras que el gas está
fluyendo, o se debe colocar la válvula del cilindro por lo menos 40 cm más alto
que la base del cilindro. Esta precaución puede ser ignorada para cilindros que
tienen una „alta porosidad“, indicado por un anillo rojo alrededor del cuello
del cilindro.
Densidad relativa
Proporcionar alto nivel aberturas de ventilación
El
acetileno tiene una densidad relativa de aproximadamente 0,9, lo que significa
que es aproximadamente un 10% más ligero que el aire. Por lo tanto, cuando no
está confinado acetileno migra hacia arriba. Las zonas de trabajo en el que el
acetileno se utiliza deben ser ventiladas en la parte superior del espacio para
evitar una peligrosa acumulación de acetileno en el aire ambiente en caso de
fugas. Sin embargo, esta disposición sólo es eficaz si un flujo de aire forzado
no está moviendo el acetileno en la otra dirección. En lugar de confiar
únicamente en esta ventilación natural, todo lo mejor por lo tanto, es evitar
fugas en el sistema de acetileno.
Calor de la compresión
Siga
las instrucciones de operación para el conjunto del cilindro de acetileno. Al igual que casi todos los gases, acetileno se calienta
cuando se comprime. Si se produce la compresión como un „golpe de ariete“, es
decir, muy rápidamente, el calor que se libera no puede ser inmediatamente dispersado
por el medio ambiente, sino que permanece en el gas comprimido. Acetileno que
de repente se comprime de 1 a 20 bar pueden alcanzar temperaturas de 250 a 300
° C, que en condiciones desfavorables, puede provocar descomposición de
acetileno.
Los
paquetes de cilindros de acetileno requieren particular atención en este
sentido. Los paquetes de cilindros de acetileno con 6 o 16 botellas de
acetileno (modelo de 46 o 61) disponen de una válvula de bola como el
dispositivo de cierre central. Esta válvula debe ser siempre activada poco a
poco, la apertura repentina puede causar un calentamiento peligroso debido a la
sobrecarga de presión. Además, antes de la manguera de suministro esté
conectada, el conector de paquete de seguridad debe ser purgado con acetileno
con una breve apertura de la válvula de bola, para eliminar el aire en la
manguera. Si no se hace, una mezcla de acetileno / aire pueden ser producida en
la manguera de suministro, esta mezcla es aún más sensible al impacto que el
acetileno puro.
4. Propiedades fisiológicas
No inhalar el acetileno en forma
concentrada
El
acetileno no es tóxico, es decir, la inhalación de acetileno no daña el cuerpo
humano. Sin embargo, el acetileno no debe ser inhalado en forma concentrada ya
que el gas tiene un efecto narcótico. (El Acetileno puro - conocido como
„narcylene“ - fue utilizado en la medicina como un agente narcótico) el
Acetileno tiene un efecto sofocante en los seres humanos. Si más del 20 vol.%
de acetileno está presente en los pulmones, la mezcla contiene menos del 17
vol.% de oxígeno y como resultado la falta de oxígeno está presente, creando la
posibilidad de asfixia.
5. Los riesgos del amianto
No son necesarias medidas de
seguridad
La
masa de alta porosidad de los cilindros de acetileno contiene una pequeña
proporción de asbesto, los cuales permanentemente cerrados, y el asbesto
permanece en el cilindro incluso si el gas es retirado. Las mediciones del
flujo de suministro de los cilindros de acetileno, han indicado claramente que
el acetileno saliente está completamente libre de asbesto. La utilización de
cilindros de acetileno que contienen rellenos porosos con amianto no constituye
un riesgo de amianto.

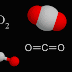



.jpg)
.jpg)
.jpg)



